
Storia della fisica, il moto browniano. Il modello microscopico della materia. Già nella seconda metà dell’Ottocento, grazie soprattutto al lavoro teorico di James Clerk Maxwell (1831-1879) e di Ludwig Boltzmann (1844-1906), si era riusciti a giustificare il comportamento di un gas ammettendo che esso fosse formato da un numero enorme di «grani» indipendenti (chiamati molecole), dotati di un moto continuo, velocissimo e casuale.
Anche esperienze quotidiane ci possono dare un’indicazione del l’esistenza del moto molecolare. Per esempio, come mai avvertiamo un profumo o un odore anche a una certa distanza dalla sua origine? Evidentemente, le molecole aromatiche si possono spostare nell’aria fino a raggiungere il nostro naso. Anche una goccia d’inchiostro posta nell’acqua si diffonde in tutte le direzioni, non soltanto verso l’alto (se è meno densa dell’acqua) o verso il basso (se è più pesante). Ma, nonostante che le previsioni teori-
che ottenute nell’ambito del modello atomico e molecolare fossero in accordo con i dati sperimentali, ancora all’inizio del Novecento l’esistenza reale degli atomi e delle molecole era tutt’altro che accettata
da molti scienziati. Molti ritenevano che essi non fossero altro che delle «entità di comodo», utili per bilanciare una reazione chimica o per descrivere le proprietà quantitative del gas perfetto, ma che, non
essendo osservabili, in fisica non si potesse parlare della loro «esistenza».
LA TEORIA DI EINSTEIN SUL MOTO BROWNIANO
Albert Einstein (1879-1955) diede un contributo fondamentale a questo dibattito individuando un fenomeno, spiegabile soltanto all’interno del modello atomico e molecolare della materia, che si prestava a una verifica sperimentale. In particolare, nel 1905 egli pubblicò una memoria scientifica nella quale esaminava il comportamento di una particella di dimensioni intermedie (cioè, abbastanza
grande da potere essere esaminata con un microscopio ottico, ma abbastanza piccola da risentire degli urti molecolari) sottoposta al continuo «bombardamento» delle molecole che costituiscono un gas o
un liquido. Va detto che, anche se l’esperimento di Brown è del 1827, Einstein non era a conoscenza del fenomeno del moto browniano. Grazie alle sue capacità teoriche, aveva però capito che in natura un
movimento di tale genere poteva essere possibile. Inoltre, fino al 1905 il moto browniano non aveva ancora avuto una soddisfacente spiegazione teorica. Dopo la sua scoperta, era stato proposto che il
moto delle particelle in sospensione in un liquido o in un gas fosse dovuto a microscopiche correnti dovute alle piccole, ma reali, differenze di temperatura tra un punto e l’altro del fluido.
IL MOTO BROWNIANO
Però, se così fosse, due particelle che si trovano molto vicine tra loro all’istante iniziale dovrebbero essere sottoposte a forze molto simili. Di conseguenza, dovrebbero descrivere traiettorie non molto diverse tra loro. Invece gli esperimenti avevano evidenziato che, in tutti i casi, i moti di due corpuscoli sono del tutto indipendenti. Una particella che si muove di moto browniano subisce circa 10 21 collisioni al secondo. Quindi non è possibile seguire (o calcolare) il suo movimento nei dettagli, istante per istante, come si fa in meccanica classica. Ciò che fece Einstein fu di studiare il comportamento medio di una particella browniana sottoposta sia al l’azione degli urti molecolari che alla viscosità del fluido in cui si trova.
In particolare, egli stabilì che vale la relazione
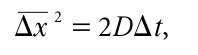 dove ⌬t è l’intervallo di tempo trascorso dal l’istante in cui abbiamo iniziato a osservare il moto della particella e ⌬ x 2 è il quadrato dell’allontanamento dal punto origine del moto, nell’intervallo ⌬t, mediato su molte particelle. D è una costante che si chiama coefficiente di diffusione.
dove ⌬t è l’intervallo di tempo trascorso dal l’istante in cui abbiamo iniziato a osservare il moto della particella e ⌬ x 2 è il quadrato dell’allontanamento dal punto origine del moto, nell’intervallo ⌬t, mediato su molte particelle. D è una costante che si chiama coefficiente di diffusione.
LA VERIFICA SPERIMENTALE DELLA TEORIA DI EINSTEIN
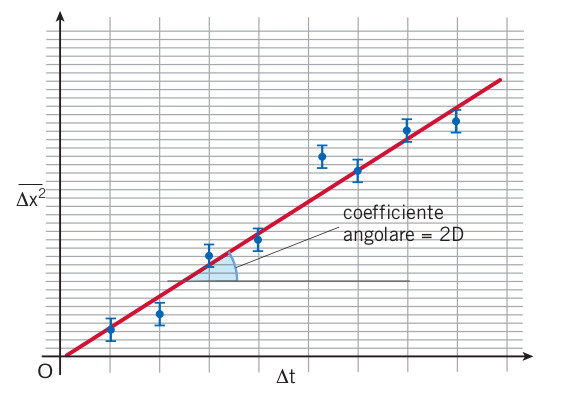
Nel caso di particelle browniane in sospensione nell’aria calma, questa previsione fu confermata dal fisico francese Jean Baptiste Perrin (1870-1942) e dai suoi collaboratori, misurando molte volte l’allontanamento di una particella browniana dal suo punto origine a valori fissati di ⌬t. Essi mostrarono che, disegnando il grafico di ⌬ x 2 in funzione di ⌬t, si otteneva una retta. Dal momento
che il coefficiente angolare di tale retta è 2D, grazie allo stesso esperimento era possibile misurare il valore numerico del coefficiente di diffusione D (figura).
 Per l’esperimento in esame la formula di Einstein dava il valore teorico di D, che risultava
Per l’esperimento in esame la formula di Einstein dava il valore teorico di D, che risultava
 dove R è la costante del gas perfetto, T è la temperatura assoluta dell’aria, è la sua viscosità e N A è il numero di Avogadro. Ciò significa che, visto che le altre grandezze sono note, dall’esperimento di Perrin fu possibile ricavare il valore del numero di Avogadro
dove R è la costante del gas perfetto, T è la temperatura assoluta dell’aria, è la sua viscosità e N A è il numero di Avogadro. Ciò significa che, visto che le altre grandezze sono note, dall’esperimento di Perrin fu possibile ricavare il valore del numero di Avogadro
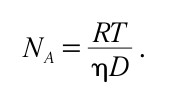 Perrin ottenne il valore N A ⫽ 6 ⫻ 10 23 , che è in buon accordo con quello noto al giorno d’oggi. Ma, al di là del valore numerico più o meno preciso, la verifica sperimentale di Perrin della teoria del moto browniano proposta da Einstein è fondamentale, nella storia della fisica, per almeno due ragioni. In primo luogo, perché confermò indirettamente la fondatezza del modello atomico e molecolare della materia: la spiegazione del moto browniano data da Einstein si basa sull’ipotesi che nella materia vi siano particelle (atomi o molecole, a seconda dei casi) in rapido movimento. La conferma delle conseguenze quantitative di tale idea fu una conferma indiretta dell’esistenza di atomi e molecole e del loro stato di incessante agitazione termica. In secondo luogo, unendo il valore di N A trovato da Perrin con altri dati che provengono dalla chimica, fu possibile avere un’idea della massa di atomi e molecole. In questo modo tali particelle, pur non essendo rilevabili direttamente, vennero a possedere delle caratteristiche misurabili. Cominciarono, cioè, ad avere diritto di cittadinanza nell’ambito della fisica.
Perrin ottenne il valore N A ⫽ 6 ⫻ 10 23 , che è in buon accordo con quello noto al giorno d’oggi. Ma, al di là del valore numerico più o meno preciso, la verifica sperimentale di Perrin della teoria del moto browniano proposta da Einstein è fondamentale, nella storia della fisica, per almeno due ragioni. In primo luogo, perché confermò indirettamente la fondatezza del modello atomico e molecolare della materia: la spiegazione del moto browniano data da Einstein si basa sull’ipotesi che nella materia vi siano particelle (atomi o molecole, a seconda dei casi) in rapido movimento. La conferma delle conseguenze quantitative di tale idea fu una conferma indiretta dell’esistenza di atomi e molecole e del loro stato di incessante agitazione termica. In secondo luogo, unendo il valore di N A trovato da Perrin con altri dati che provengono dalla chimica, fu possibile avere un’idea della massa di atomi e molecole. In questo modo tali particelle, pur non essendo rilevabili direttamente, vennero a possedere delle caratteristiche misurabili. Cominciarono, cioè, ad avere diritto di cittadinanza nell’ambito della fisica.
 Scarica l’articolo in formato originale pdf Einstein ed il moto browniano
Scarica l’articolo in formato originale pdf Einstein ed il moto browniano




Lascia un commento