“Questa decisione del CHMP rende più vicina ai pazienti europei che hanno esaurito i trattamenti disponibili la possibilità di accesso a un’opzione innovativa,” ha detto Zack Pemberton-Whiteley, Chair of the Global Acute Leukemia Advocates Network and Campaigns and Advocacy Director at Leukaemia Care. “È importante sottolineare che la terapia CAR-T è adatta a un gruppo selezionato di pazienti. Lavorare con i medici specialisti per garantire un accesso sicuro e tempestivo a chi ne ha bisogno sarà di fondamentale importanza.”
L’opinione positiva del CHMP si basa su due studi multicentrici globali di fase II, ELIANA e JULIET, che hanno incluso pazienti in Europa, negli Stati Uniti, in Australia, in Canada e in Giappone. La Commissione Europea esaminerà ora la raccomandazione ed emetterà nelle prossime settimane la sua decisione finale, applicabile a tutti i 28 stati membri della UE, oltre a Islanda, Liechtenstein e Norvegia.
“Negli Stati Uniti tisagenlecleucel sta già trasformando il modo in cui trattiamo alcuni tipi di leucemia e di linfoma, e sta dimostrando che le terapie cellulari personalizzate costituiscono strumenti estremamente potenti per la lotta contro il cancro”, ha dichiarato Carl June, MD, Richard W. Vague Professor in Immunotherapy presso il dipartimento di Pathology and Laboratory Medicine e direttore del Center for Cellular Immunotherapies presso l’Abramson Cancer Center. “Siamo entusiasti di constatare che, grazie alla nostra collaborazione con Novartis, i medici di diversi Paesi del mondo potrebbero essere in grado di utilizzare questa nuova e innovativa terapia cellulare CAR-T per migliorare gli esiti del trattamento nei loro pazienti”.
Se sarà approvato dalla Commissione Europea, tisagenlecleucel diventerà la prima terapia cellulare CAR-T disponibile nell’Unione Europea sia per il DLBCL sia per la LLA a cellule B.
LA TECNICA
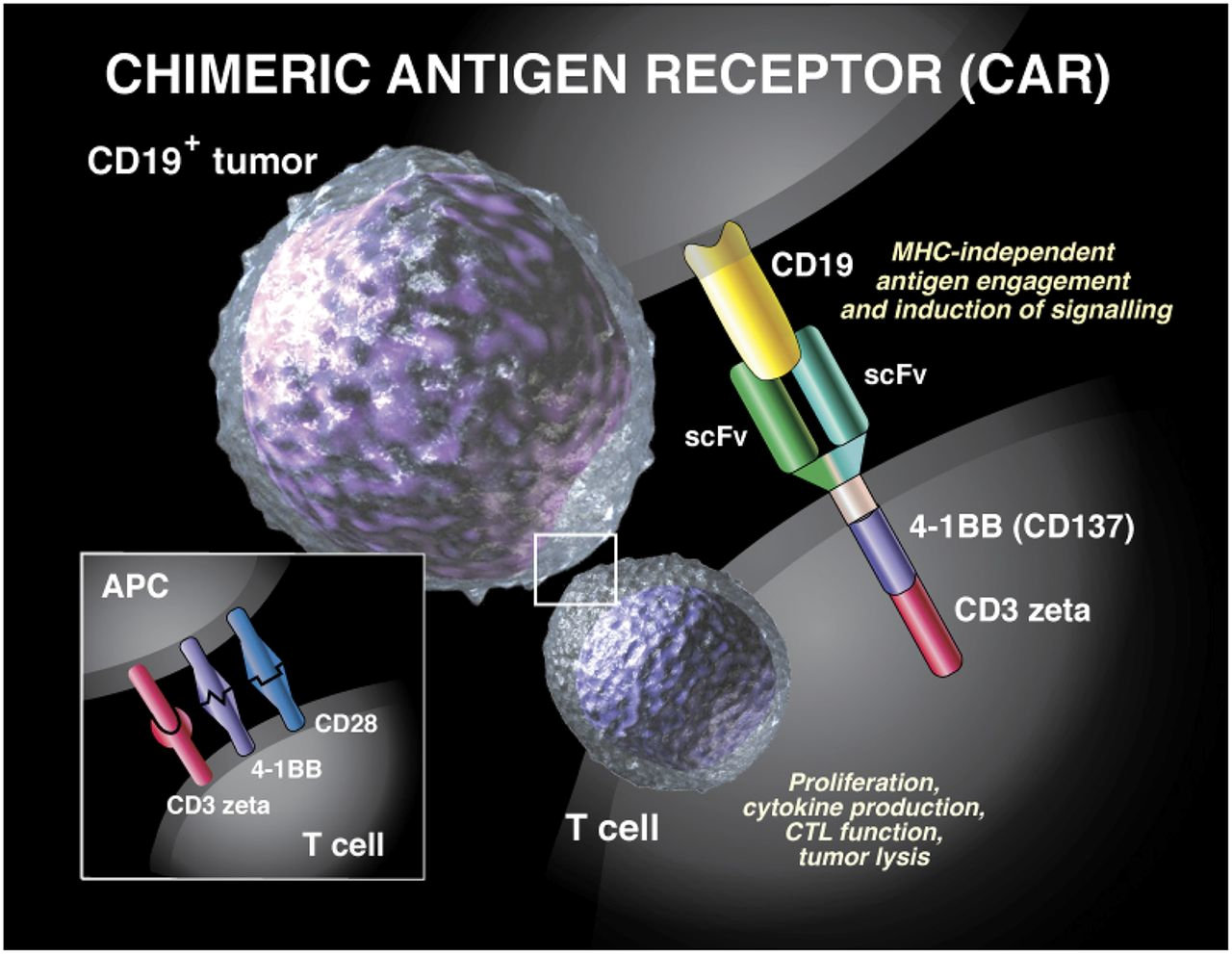
La CAR-T è diversa dalle tipiche terapie biologiche o a piccole molecole, perché viene prodotta per ogni singolo paziente, utilizzando le sue stesse cellule. Durante il trattamento, le cellule T vengono prelevate dal sangue del paziente e riprogrammate in laboratorio, al fine di creare cellule T geneticamente modificate per riconoscere e combattere le cellule tumorali e altre cellule B che esprimono uno specifico antigene. Il processo di produzione di CAR-T di Novartis prevede la crioconservazione, cioè il processo di congelamento delle cellule che sono state prelevate dal paziente per poterle conservare. Questo consente ai medici la flessibilità di decidere quando iniziare sia la raccolta delle cellule del paziente, sia l’infusione delle cellule modificate, scegliendo il momento più adatto in base alle condizioni del paziente e permette un approccio individualizzato al trattamento su scala globale.
LE PATOLOGIE
La LLA a cellule B e il DLBCL sono entrambi neoplasie aggressive, caratterizzate da importanti carenze terapeutiche per i pazienti. In Europa, la LLA rappresenta l’80% circa dei casi di leucemia tra i bambini e in caso di ricaduta di malattia la prognosi è scarsa. Il tasso di sopravvivenza è basso nonostante i pazienti si sottopongano a diversi trattamenti, tra i quali chemioterapia, radioterapia, terapia mirata o trapianto di cellule staminali.
Il DLBCL – il sottotipo di linfoma non Hodgkin più diffuso – rappresenta fino al 40% di tutti i casi a livello globale. Per i pazienti che sperimentano recidiva o che non rispondono alla terapia iniziale, le opzioni di trattamento in grado di fornire risposte durature sono limitate, e – per la maggior parte dei pazienti – i tassi di sopravvivenza sono bassi, a causa della non eleggibilità al trapianto autologo di cellule staminali (ASCT, autologous stem cell transplant) o del fallimento della chemioterapia di salvataggio e dell’ASCT.
“L’odierna opinione positiva del CHMP rappresenta una tappa epocale per coloro che sono stati colpiti da questi tipi aggressivi di neoplasie a cellule B in fase avanzata”, ha affermato il dott. Ulrich Jäger, Professore di ematologia presso l’Università di Medicina di Vienna e Responsabile del Dipartimento di Ematologia presso l’Ospedale Generale della Città di Vienna. “I pazienti e i medici europei hanno atteso con ansia l’introduzione di tisagenlecleucel, che porterà una significativa evoluzione del panorama terapeutico di questi pazienti, caratterizzati da una prognosi infausta”.
DOPPIA SPERANZA
A ricevere l’approvazione del CHMP è oggi anche un’altra terapia Car-T, axicabtagene ciloleucel. Ad averla sviluppata è stata la biotech Kite, ora acquisita da Gilead. Le patologie che potranno essere trattate con questa tecnologia, una volta ottenuto il via libera dalla Commissione Europea, saranno anche in questo caso il linfoma diffuso a grandi cellule B (DLBCL) che non risponde o che progredisce dopo due o più linee di terapia sistemica negli adulti, e il linfoma primitivo del mediastino a grandi cellule B dopo il fallimento di due o più linee di trattamento.




Lascia un commento