
Vi abbiamo abituati a pensare allo zero assoluto come a una temperatura irraggiungibile, così che l’idea che si possa andare sotto vi può sembrare assurda. Ma in realtà il concetto di temperatura negativa ha un suo senso fisico. E tanto per confondere ulteriormente le idee, un sistema a temperatura negativa è in realtà più caldo rispetto allo stesso sistema a qualunque temperatura positiva. Com’è possibile? Qualcosa va sviscerato nel concetto di temperatura. Abbiamo già visto come nasce il concetto di temperatura, ma per capirlo meglio ci occorrerà un piccolo excursus nella termodinamica e nella meccanica statistica.
La termodinamica classica si occupa degli stati macroscopici di un sistema fisico nel suo complesso, chiamati “macrostati” e per caratterizzarli usiamo quantità dette “variabili di stato”: temperatura, pressione, densità e volume. La meccanica statistica, invece, si occupa dei “microstati” di un sistema, cioè tutte le sue possibili configurazioni microscopiche, e di come queste possono essere descritte dalle leggi della statistica per dare origine, col loro comportamento collettivo, alle quantità macroscopiche osservabili. In genere, a ogni stato macroscopico possibile corrisponde un certo numero di microstati.
Proviamo a spiegarlo con il poker: al macrostato “scala reale di cuori” corrisponderà un solo microstato, ossia una sola configurazione di carte, mentre ci saranno moltissimi microstati che corrisponderanno al generico macrostato “coppia” (oltre un milione, secondo il calcolo combinatorio).
Ludwig Boltzmann collegò il numero di microstati di un sistema fisico alla sua entropia, di modo che l’entropia di uno stato cresce al crescere del numero di microstati corrispondenti. In questo modo, consistentemente col secondo principio della termodinamica, un sistema chiuso tende a raggiungere la massima entropia. In questa interpretazione, una coppia a poker ha un’entropia molto più alta di una scala reale di cuori.
In generale, quando forniamo energia a un sistema, ad esempio scaldando un gas, le sue molecole potranno muoversi più velocemente e distribuirsi l’energia in più modi diversi. Aumenta quindi il numero di microstati accessibili e di conseguenza anche l’entropia. Se si sottrae energia, l’entropia invece diminuisce. In altre parole, solitamente all’immissione di una certa energia, che chiamiamo dQ, corrisponde un aumento di entropia, che chiamiamo dS, e viceversa. La temperatura si definisce come il rapporto tra queste due grandezze: T = dQ/dS, e nei casi considerati finora è sempre positiva.
Ci sono però sistemi fisici per cui questo non vale. Per esempio, consideriamo un caso ideale molto specifico: un sistema quantistico costituito da un numero finito di N atomi con spin ½ vincolati a un filo unidimensionale, il cui unico grado di libertà è quello di invertire il proprio spin passando da “su” a “giù” e viceversa. L’energia totale del sistema all’interno di un campo magnetico B è data dalla formula
E=(N↑–N↓)μB
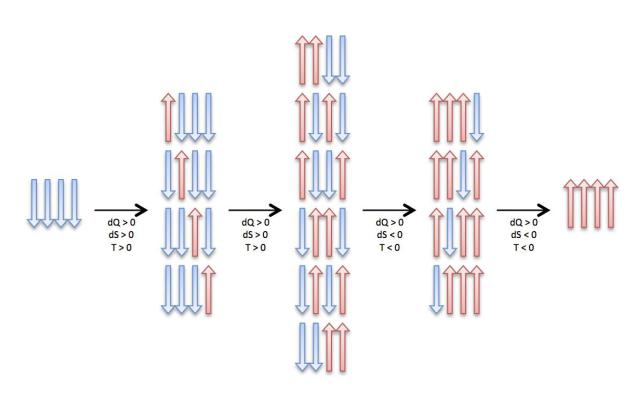
dove N↑ ed N↓ sono rispettivamente il numero di atomi con spin “su” e spin “giù” e μ è il momento magnetico di ciascun atomo. L’energia è nulla quando il numero di atomi con spin “su” e spin “giù” è lo stesso, positiva quando ci sono più atomi con spin “su” e negativa quando ci sono più atomi con spin “giù”. Lo stato ad energia minima si ha nell’unica configurazione in cui tutti gli spin sono “giù”. In questo caso l’entropia è nulla perché c’è un solo microstato possibile, tutti giù.
Se ora aggiungiamo un quanto di energia, uno degli atomi invertirà il suo spin: avremo un atomo con spin “su” e tutti gli altri con spin “giù”. Siccome non fa differenza quale degli N atomi sia, avremo N configurazioni equivalenti, quindi l’entropia aumenterà: a un aumento di calore corrisponde un aumento di entropia e quindi la temperatura è positiva. Se forniamo un altro quanto di energia, un altro atomo passerà da spin “giù” a spin “su”; a questo punto avremo un numero maggiore di configurazioni possibili (il calcolo combinatorio ci dice che sono N(N–1)/2) e quindi anche in questo caso l’entropia aumenterà e la temperatura resterà positiva.
Ma consideriamo ora lo stato a energia massima: esso ha tutti gli spin “su”. Anche a questo stato di massima energia corrisponde un solo microstato (tutti su), e la sua entropia è zero. Se sottraiamo un quanto di energia al sistema, uno degli atomi passerà da spin “su” a spin “giù”. Anche a questo stato corrispondono N possibili configurazioni, dato che qualunque atomo può aver invertito il suo spin. In questo caso, l’entropia è aumentata nonostante si sia sottratto calore. Poiché il rapporto tra dQ e dS è in questo caso negativo, anche la temperatura è negativa. Sottraendo via via quanti di energia, l’entropia continua a crescere, fino a raggiungere il valore massimo quando metà degli spin sono su e metà sono giù e siamo tornati alla configurazione a energia zero.
Abbiamo dunque creato un sistema in cui, partendo dallo stato di minima energia e aggiungendo calore, la temperatura inizialmente è positiva e sale fino allo stato di massima entropia, dopodiché diventa negativa. Quando il sistema è a temperatura negativa, è più caldo di quando è a temperatura positiva; mettendo a contatto il sistema a temperatura negativa e quello a temperatura positiva, il calore fluirebbe dal primo al secondo.
Un sistema di questo tipo è realizzabile? Sì, se esistono un limite inferiore e superiore per l’energia del sistema; sistemi a temperatura negativa sono stati realizzati sin dagli anni Cinquanta, limitandosi però a considerare soltanto le energie associate allo spin, come nel caso che abbiamo illustrato. Se si considerano anche gli altri gradi di libertà, quelli di movimento, la faccenda si fa più difficile, dato che l’energia raggiungibile nel movimento in linea di principio non ha limiti. Tuttavia, nel 2013, un gruppo di ricercatori dell’Università di Monaco e del Max Planck Institut di Garching ha portato la temperatura di una nube di atomi di potassio a qualche miliardesimo di kelvin sotto lo zero anche per i suoi gradi di libertà di movimento.
Le applicazioni della temperatura negativa contemplano amplificatori a radiofrequenza quantistici, motori termici con efficienza superiore al 100% che non violano i principi della termodinamica e, secondo alcuni, anche una spiegazione dell’energia oscura nell’Universo. Nessuna di queste, però, sembra plausibile in un futuro prossimo. Ci dovremo accontentare per il momento di aver creato un altro tassello nella ricerca di base.




Lascia un commento